PRP สมัยใหม่: “Clinical PRP”
ในช่วง 10 ปีที่ผ่านมา รูปแบบการรักษาของ PRP มีการเปลี่ยนแปลงอย่างมากด้วยการวิจัยเชิงทดลองและทางคลินิก ขณะนี้เรามีความเข้าใจที่ดีขึ้นเกี่ยวกับเกล็ดเลือดและสรีรวิทยาของเซลล์อื่นๆนอกจากนี้ การประเมินอย่างเป็นระบบคุณภาพสูง การวิเคราะห์เมตา และการทดลองแบบสุ่มที่มีกลุ่มควบคุมหลายรายการได้แสดงให้เห็นถึงประสิทธิภาพของเทคโนโลยีชีวภาพ PRP ในสาขาการแพทย์จำนวนมาก รวมถึงโรคผิวหนัง ศัลยกรรมหัวใจ ศัลยกรรมพลาสติก ศัลยกรรมกระดูก การจัดการความเจ็บปวด โรคกระดูกสันหลัง และเวชศาสตร์การกีฬา .
ลักษณะปัจจุบันของ PRP คือความเข้มข้นของเกล็ดเลือดสัมบูรณ์ ซึ่งเปลี่ยนจากคำจำกัดความเริ่มต้นของ PRP (รวมถึงความเข้มข้นของเกล็ดเลือดที่สูงกว่าค่าพื้นฐาน) ไปเป็นมากกว่า 1 × 10 6/µ L หรือประมาณ 5 เท่าของความเข้มข้นของเกล็ดเลือดขั้นต่ำในเกล็ดเลือดจาก พื้นฐานในการทบทวนอย่างละเอียดโดย Fadadu และคณะมีการประเมินระบบและโปรโตคอล PRP 33 รายการจำนวนเกล็ดเลือดของการเตรียม PRP ขั้นสุดท้ายที่ผลิตโดยระบบเหล่านี้บางส่วนจะต่ำกว่าของเลือดทั้งหมดพวกเขารายงานว่าปัจจัยเกล็ดเลือดของ PRP เพิ่มขึ้นต่ำถึง 0.52 ด้วยชุดสปินเดี่ยว (Selphyl ®)ในทางตรงกันข้าม EmCyte Genesis PurePRPII ® แบบหมุนสองครั้ง ความเข้มข้นของเกล็ดเลือดที่ผลิตโดยอุปกรณ์จะสูงที่สุด (1.6 × 10 6 /µL)
แน่นอนว่าวิธีในหลอดทดลองและในสัตว์ไม่ใช่สภาพแวดล้อมการวิจัยในอุดมคติสำหรับการเปลี่ยนแปลงไปสู่การปฏิบัติทางคลินิกได้สำเร็จในทำนองเดียวกัน การศึกษาเปรียบเทียบอุปกรณ์ไม่สนับสนุนการตัดสินใจ เนื่องจากแสดงให้เห็นว่าความเข้มข้นของเกล็ดเลือดระหว่างอุปกรณ์ PRP นั้นแตกต่างกันมากโชคดีที่ด้วยเทคโนโลยีและการวิเคราะห์เชิงโปรตีโอมิกส์ เราสามารถเพิ่มความเข้าใจเกี่ยวกับการทำงานของเซลล์ใน PRP ที่ส่งผลต่อผลการรักษาได้ก่อนที่จะบรรลุข้อตกลงร่วมกันเกี่ยวกับการเตรียมและสูตร PRP ที่เป็นมาตรฐาน PRP ควรปฏิบัติตามสูตร PRP ทางคลินิกเพื่อส่งเสริมกลไกการซ่อมแซมเนื้อเยื่อที่สำคัญและผลลัพธ์ทางคลินิกที่ก้าวหน้า
สูตร PRP ทางคลินิก
ปัจจุบัน PRP ทางคลินิกที่มีประสิทธิผล (C-PRP) มีลักษณะเป็นองค์ประกอบที่ซับซ้อนของส่วนประกอบหลายเซลล์อัตโนมัติในพลาสมาปริมาณน้อยที่ได้มาจากส่วนหนึ่งของเลือดส่วนปลายหลังจากการปั่นแยกหลังจากการปั่นแยก PRP และส่วนประกอบของเซลล์ที่ไม่ใช่เกล็ดเลือดสามารถนำกลับมาใช้ใหม่ได้จากอุปกรณ์วัดความเข้มข้นตามความหนาแน่นของเซลล์ที่แตกต่างกัน (ซึ่งมีความหนาแน่นของเกล็ดเลือดต่ำที่สุด)
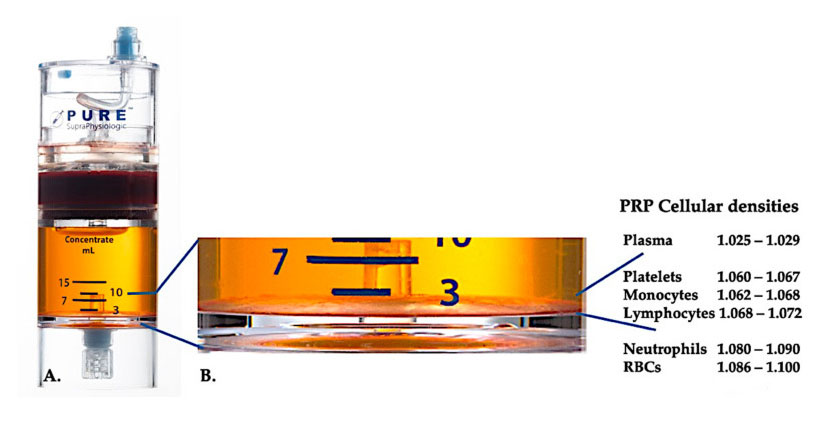
ใช้อุปกรณ์แยกความหนาแน่นของเซลล์ PurePRP-SP ® (EmCyte Corporation, Fort Myers, FL, USA) ใช้สำหรับเลือดครบส่วนหลังจากขั้นตอนการปั่นเหวี่ยงสองขั้นตอนหลังจากกระบวนการปั่นแยกครั้งแรก ส่วนประกอบของเลือดครบส่วนจะถูกแยกออกเป็นสองชั้นพื้นฐาน ชั้นพลาสมาแขวนลอยของเกล็ดเลือด (ไร้มัน) และชั้นเซลล์เม็ดเลือดแดงใน A ขั้นตอนการปั่นแยกครั้งที่สองเสร็จสิ้นแล้วสามารถดึงปริมาตร PRP จริงออกมาเพื่อใช้ในผู้ป่วยได้กำลังขยายใน B แสดงให้เห็นว่ามีชั้นสีน้ำตาลของการตกตะกอนของเม็ดเลือดแดงหลายองค์ประกอบ (แสดงด้วยเส้นสีน้ำเงิน) ที่ด้านล่างของอุปกรณ์ ซึ่งมีเกล็ดเลือด มอนอไซต์ และลิมโฟไซต์ที่มีความเข้มข้นสูง โดยอิงตามการไล่ระดับความหนาแน่นในตัวอย่างนี้ ตามเกณฑ์วิธีการเตรียม C-PRP ที่มีนิวโทรฟิลต่ำ เปอร์เซ็นต์ขั้นต่ำของนิวโทรฟิล (<0.3%) และเม็ดเลือดแดง (<0.1%) จะถูกสกัด
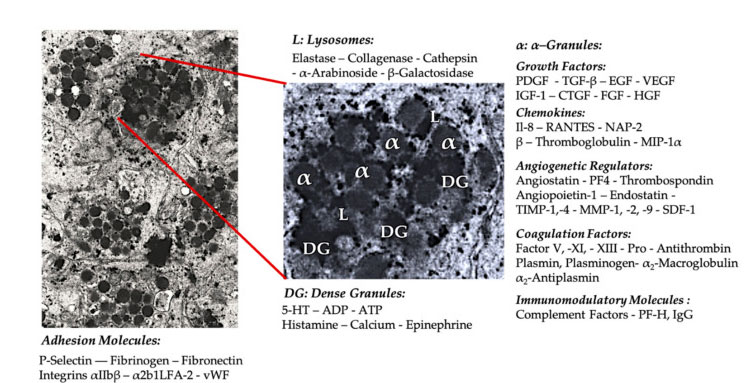
เกล็ดเลือดเม็ด
ในการใช้งาน PRP ทางคลินิกในช่วงแรก α-Granules เป็นโครงสร้างภายในของเกล็ดเลือดที่ถูกอ้างถึงบ่อยที่สุด เนื่องจากมีปัจจัยการแข็งตัวของเลือด PDGF จำนวนมาก และตัวควบคุมการสร้างเส้นเลือดใหม่ แต่มีฟังก์ชันการเกิดลิ่มเลือดเพียงเล็กน้อยปัจจัยอื่นๆ ได้แก่ ส่วนประกอบของคีโมไคน์และไซโตไคน์ที่ไม่ค่อยมีใครรู้จัก เช่น เกล็ดเลือดแฟคเตอร์ 4 (PF4) โปรตีนพื้นฐานพรีเกล็ดเลือด P-selectin (ตัวกระตุ้นของอินทิกริน) และคีโมไคน์ RANTES (ควบคุมโดยการกระตุ้น การแสดงทีเซลล์ปกติและสันนิษฐานได้ การหลั่ง)หน้าที่โดยรวมของส่วนประกอบเม็ดเกล็ดเลือดจำเพาะเหล่านี้คือการรับสมัครและกระตุ้นเซลล์ภูมิคุ้มกันอื่นๆ หรือกระตุ้นให้เซลล์บุผนังหลอดเลือดอักเสบ
ส่วนประกอบที่เป็นเม็ดละเอียด เช่น ADP, เซโรโทนิน, โพลีฟอสเฟต, ฮิสตามีน และอะดรีนาลีน ถูกใช้โดยปริยายเป็นตัวควบคุมการกระตุ้นเกล็ดเลือดและการเกิดลิ่มเลือดสิ่งสำคัญที่สุดคือองค์ประกอบหลายอย่างเหล่านี้มีหน้าที่ในการปรับเปลี่ยนเซลล์ภูมิคุ้มกันPlatelet ADP ได้รับการยอมรับโดยตัวรับ P2Y12ADP บนเซลล์ dendritic (DC) ซึ่งจะเป็นการเพิ่มการสร้างแอนติเจนของเซลล์DC (เซลล์นำเสนอแอนติเจน) มีความสำคัญมากในการเริ่มต้นการตอบสนองทางภูมิคุ้มกันของทีเซลล์และการควบคุมการตอบสนองของระบบภูมิคุ้มกันเชิงป้องกัน ซึ่งเชื่อมโยงระบบภูมิคุ้มกันโดยธรรมชาติและระบบภูมิคุ้มกันแบบปรับตัวนอกจากนี้ เกล็ดเลือดอะดีโนซีน ไตรฟอสเฟต (ATP) ส่งสัญญาณผ่านตัวรับทีเซลล์ P2X7 ซึ่งนำไปสู่การเพิ่มความแตกต่างของเซลล์ CD4 T helper ไปเป็นเซลล์ T helper 17 (Th17) ที่ทำให้เกิดการอักเสบส่วนประกอบของเกล็ดเลือดหนาแน่นอื่นๆ (เช่น กลูตาเมตและเซโรโทนิน) กระตุ้นให้เกิดการย้ายถิ่นของทีเซลล์ และเพิ่มความแตกต่างของโมโนไซต์เป็น DC ตามลำดับใน PRP สารปรับภูมิคุ้มกันที่ได้มาจากอนุภาคหนาแน่นจะเสริมสมรรถนะสูงและมีหน้าที่ภูมิคุ้มกันที่สำคัญ
จำนวนปฏิสัมพันธ์ที่อาจเกิดขึ้นทั้งทางตรงและทางอ้อมระหว่างเกล็ดเลือดและเซลล์ (ตัวรับ) อื่นๆ มีมากมายดังนั้นการใช้ PRP ในสภาพแวดล้อมของเนื้อเยื่อพยาธิวิทยาในท้องถิ่นสามารถกระตุ้นให้เกิดผลการอักเสบได้หลากหลาย
ความเข้มข้นของเกล็ดเลือด
C-PRP ควรมีเกล็ดเลือดเข้มข้นในปริมาณทางคลินิกเพื่อให้เกิดผลการรักษาที่เป็นประโยชน์เกล็ดเลือดใน C-PRP ควรกระตุ้นการเพิ่มจำนวนเซลล์ การสังเคราะห์ปัจจัยมีเซนไคม์และนิวโรโทรฟิก ส่งเสริมการอพยพของเซลล์เคมีบำบัด และกระตุ้นการทำงานของระบบภูมิคุ้มกัน ดังแสดงในรูป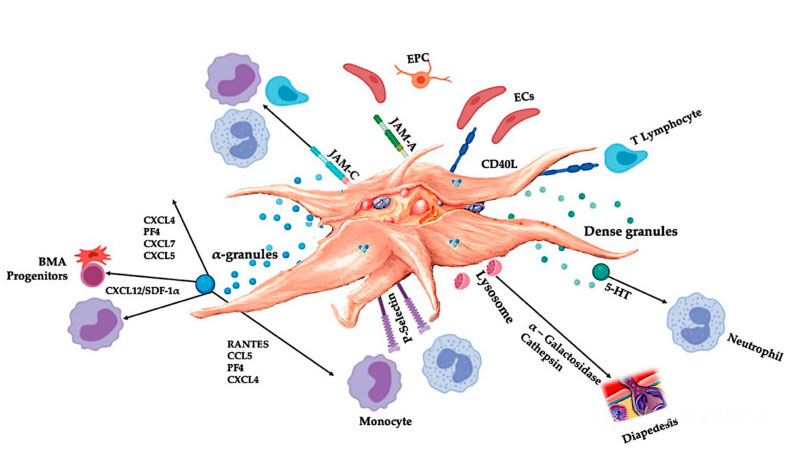
เกล็ดเลือดที่ถูกกระตุ้น การปล่อย PGF และโมเลกุลการยึดเกาะจะเป็นสื่อกลางในปฏิกิริยาระหว่างเซลล์ต่างๆ เช่น เคมีบำบัด การยึดเกาะของเซลล์ การย้ายถิ่น และการสร้างความแตกต่างของเซลล์ และควบคุมกิจกรรมการควบคุมระบบภูมิคุ้มกันปฏิกิริยาระหว่างเซลล์และเซลล์เกล็ดเลือดเหล่านี้มีส่วนทำให้เกิดการสร้างเส้นเลือดใหม่และกิจกรรมการอักเสบ และกระตุ้นกระบวนการซ่อมแซมเนื้อเยื่อในท้ายที่สุดคำย่อ: BMA: การดูดจากไขกระดูก, EPC: เซลล์ต้นกำเนิดบุผนังหลอดเลือด, EC: เซลล์บุผนังหลอดเลือด, 5-HT: 5-ไฮดรอกซีทริปตามีน, RANTES: ควบคุมการแสดงออกของทีเซลล์ปกติและการหลั่งสมมุติ, JAM: ประเภทโมเลกุลของการยึดเกาะที่จุดเชื่อมต่อ, CD40L: คลัสเตอร์ 40 ลิแกนด์, SDF-1 α: ปัจจัยที่ได้มาจากเซลล์ Stromal-1 α, CXCL: chemokine (CXC motif) ลิแกนด์, PF4: ปัจจัยเกล็ดเลือด 4 ดัดแปลงมาจาก Everts และคณะ
มาร์กซ์เป็นคนแรกที่พิสูจน์ว่าการรักษากระดูกและเนื้อเยื่ออ่อนได้รับการปรับปรุง และจำนวนเกล็ดเลือดขั้นต่ำคือ 1 × 10 6 /µL ผลลัพธ์เหล่านี้ได้รับการยืนยันในการศึกษาการหลอมรวมของกระดูกสันหลังส่วนเอวผ่านทางช่องไขสันหลัง เมื่อปริมาณเกล็ดเลือดมากกว่า 1.3 × ที่ 106 เกล็ดเลือด/ไมโครลิตร การศึกษานี้แสดงให้เห็นการหลอมรวมมากขึ้นนอกจากนี้ Giusti และคณะเปิดเผย 1.5 × กลไกการซ่อมแซมเนื้อเยื่อในขนาด 109 ต้องใช้เกล็ดเลือด/มล. เพื่อกระตุ้นการสร้างเส้นเลือดใหม่ผ่านการทำงานของเซลล์บุผนังหลอดเลือดในการศึกษาหลังนี้ ความเข้มข้นที่สูงขึ้นจะลดศักยภาพในการสร้างเส้นเลือดใหม่ของเกล็ดเลือดในและรอบๆ ฟอลลิเคิลนอกจากนี้ข้อมูลก่อนหน้านี้ยังแสดงให้เห็นว่าปริมาณของ PRP จะส่งผลต่อผลการรักษาด้วยดังนั้น เพื่อกระตุ้นปฏิกิริยาการสร้างเส้นเลือดใหม่อย่างมีนัยสำคัญและกระตุ้นการเพิ่มจำนวนเซลล์และการย้ายเซลล์ C-PRP ควรมีอย่างน้อย 7.5 ในขวดบำบัด PRP ขนาด 5 มล. × 10 9 ที่สามารถส่งเกล็ดเลือดได้
นอกเหนือจากการขึ้นอยู่กับขนาดยาแล้ว ผลของ PRP ต่อการทำงานของเซลล์ดูเหมือนจะขึ้นอยู่กับเวลาเป็นอย่างมากโซฟีและคณะผลลัพธ์เหล่านี้ชี้ให้เห็นว่าการสัมผัสเกล็ดเลือดไลเซตของมนุษย์ในระยะสั้นสามารถกระตุ้นการเพิ่มจำนวนเซลล์กระดูกและเคมีบำบัดได้ในทางตรงกันข้าม การได้รับ PRP เป็นเวลานานจะทำให้ระดับอัลคาไลน์ฟอสฟาเตสและการก่อตัวของแร่ธาตุลดลง
เซลล์เม็ดเลือดแดง
เซลล์เม็ดเลือดแดงมีหน้าที่ขนส่งออกซิเจนไปยังเนื้อเยื่อและถ่ายโอนคาร์บอนไดออกไซด์จากเนื้อเยื่อไปยังปอดพวกมันไม่มีนิวเคลียสและประกอบด้วยโมเลกุลฮีมที่จับกับโปรตีนส่วนประกอบของธาตุเหล็กและฮีมในเซลล์เม็ดเลือดแดงส่งเสริมการรวมกันของออกซิเจนและคาร์บอนไดออกไซด์โดยทั่วไปวงจรชีวิตของเม็ดเลือดแดงจะอยู่ที่ประมาณ 120 วันพวกมันจะถูกกำจัดออกจากการไหลเวียนโดยแมคโครฟาจผ่านกระบวนการที่เรียกว่า RBC agingเซลล์เม็ดเลือดแดงในตัวอย่าง PRP อาจได้รับความเสียหายภายใต้สภาวะแรงเฉือน (เช่น การผ่าตัดเลือดออกทั้งเลือด กระบวนการที่ใช้ภูมิคุ้มกันเป็นสื่อกลาง ความเครียดจากปฏิกิริยาออกซิเดชัน หรือรูปแบบความเข้มข้นของ PRP ที่ไม่เพียงพอ)ดังนั้นเยื่อหุ้มเซลล์ RBC จะสลายตัวและปล่อยฮีโมโกลบินที่เป็นพิษ (Hb) ซึ่งวัดโดยฮีโมโกลบินอิสระในพลาสมา (PFH) ฮีม และธาตุเหล็ก]PFH และผลิตภัณฑ์จากการย่อยสลาย (ฮีมและธาตุเหล็ก) ร่วมกันก่อให้เกิดผลที่เป็นอันตรายและเป็นพิษต่อเนื้อเยื่อ นำไปสู่ความเครียดจากปฏิกิริยาออกซิเดชัน การสูญเสียไนตริกออกไซด์ การกระตุ้นวิถีการอักเสบ และกดภูมิคุ้มกันผลกระทบเหล่านี้จะนำไปสู่ความผิดปกติของจุลภาคในที่สุด การหดตัวของหลอดเลือดในท้องถิ่น และการบาดเจ็บของหลอดเลือด รวมถึงความเสียหายของเนื้อเยื่ออย่างรุนแรง
สิ่งที่สำคัญที่สุดคือเมื่อส่ง RBC ที่มี C-PRP ไปยังเนื้อเยื่อ จะทำให้เกิดปฏิกิริยาเฉพาะที่ที่เรียกว่า eryptosis ซึ่งจะกระตุ้นการปล่อยไซโตไคน์และตัวยับยั้งการย้ายถิ่นของมาโครฟาจที่มีประสิทธิภาพไซโตไคน์นี้ยับยั้งการย้ายถิ่นของโมโนไซต์และมาโครฟาจมันส่งสัญญาณที่สนับสนุนการอักเสบที่รุนแรงไปยังเนื้อเยื่อโดยรอบ ยับยั้งการย้ายถิ่นของเซลล์ต้นกำเนิดและการแพร่กระจายของไฟโบรบลาสต์ และนำไปสู่ความผิดปกติของเซลล์เฉพาะที่อย่างมีนัยสำคัญดังนั้นจึงเป็นเรื่องสำคัญที่จะต้องจำกัดการปนเปื้อนของ RBC ในการเตรียม PRPนอกจากนี้ยังไม่เคยมีการกำหนดบทบาทของเซลล์เม็ดเลือดแดงในการสร้างเนื้อเยื่อใหม่การปั่นแยกและการเตรียม C-PRP ที่เพียงพอมักจะลดหรือกำจัดการมีเซลล์เม็ดเลือดแดง ดังนั้นจึงหลีกเลี่ยงผลเสียของภาวะเม็ดเลือดแดงแตกและภาวะโพลีไซเธเมีย
เม็ดเลือดขาวใน C-PRP
การมีอยู่ของเม็ดเลือดขาวในการเตรียม PRP ขึ้นอยู่กับอุปกรณ์การรักษาและแผนการเตรียมการในอุปกรณ์ PRP ที่ใช้พลาสมา เซลล์เม็ดเลือดขาวจะถูกกำจัดออกไปโดยสิ้นเชิงอย่างไรก็ตาม เซลล์เม็ดเลือดขาวมีความเข้มข้นอย่างมีนัยสำคัญในการเตรียม PRP ของชั้นสีน้ำตาลตกตะกอนของเม็ดเลือดแดงเนื่องจากกลไกการป้องกันภูมิคุ้มกันและโฮสต์ เซลล์เม็ดเลือดขาวจึงส่งผลกระทบอย่างมากต่อชีววิทยาภายในของสภาวะเนื้อเยื่อเฉียบพลันและเรื้อรังคุณสมบัติเหล่านี้จะกล่าวถึงเพิ่มเติมด้านล่างดังนั้นการมีเม็ดเลือดขาวจำเพาะใน C-PRP อาจทำให้เกิดผลกระทบต่อเซลล์และเนื้อเยื่ออย่างมีนัยสำคัญโดยเฉพาะอย่างยิ่ง ระบบการตกตะกอนของเม็ดเลือดแดง PRP ที่แตกต่างกันในชั้นสีน้ำตาล-เหลืองใช้แผนการเตรียมการที่แตกต่างกัน ดังนั้นจึงผลิตสัดส่วนของนิวโทรฟิล ลิมโฟไซต์ และโมโนไซต์ใน PRP ที่แตกต่างกันอีโอซิโนฟิลและเบโซฟิลไม่สามารถวัดได้ในการเตรียม PRP เนื่องจากเยื่อหุ้มเซลล์เปราะบางเกินกว่าจะต้านทานแรงในการประมวลผลแบบแรงเหวี่ยง
นิวโทรฟิล
นิวโทรฟิลเป็นเม็ดเลือดขาวที่จำเป็นในการรักษาหลายวิธีเส้นทางเหล่านี้รวมกับโปรตีนต้านจุลชีพที่มีอยู่ในเกล็ดเลือดเพื่อสร้างเกราะป้องกันหนาแน่นต่อเชื้อโรคที่รุกรานการมีอยู่ของนิวโทรฟิลจะขึ้นอยู่กับเป้าหมายการรักษาของ C-PRPระดับการอักเสบของเนื้อเยื่อที่เพิ่มขึ้นอาจจำเป็นในการบำบัดด้วย PRP การดูแลบาดแผลเรื้อรัง หรือในการใช้งานที่มุ่งเป้าไปที่การเจริญเติบโตของกระดูกหรือการรักษาที่สำคัญมีการค้นพบฟังก์ชันนิวโทรฟิลเพิ่มเติมในหลายแบบจำลอง โดยเน้นบทบาทของพวกเขาในการสร้างเส้นเลือดใหม่และการซ่อมแซมเนื้อเยื่ออย่างไรก็ตาม นิวโทรฟิลสามารถก่อให้เกิดผลเสียได้ ดังนั้นจึงไม่เหมาะกับการใช้งานบางประเภทโจวและหวังได้พิสูจน์แล้วว่าการใช้ PRP ที่อุดมไปด้วยนิวโทรฟิลสามารถนำไปสู่การเพิ่มขึ้นของอัตราส่วนของคอลลาเจนประเภทที่ 3 ต่อคอลลาเจนประเภทที่ 1 ซึ่งส่งผลให้พังผืดรุนแรงขึ้นและลดความแข็งแรงของเส้นเอ็นลักษณะที่เป็นอันตรายอื่นๆ ที่นิวโทรฟิลเป็นสื่อกลางคือการปล่อยไซโตไคน์ที่มีการอักเสบและเมทริกซ์เมทัลโลโปรตีนเนส (MMPs) ซึ่งสามารถส่งเสริมการอักเสบและแคแทบอลิซึมเมื่อนำไปใช้กับเนื้อเยื่อ
เม็ดเลือดขาว
ใน C-PRP นั้น โมโนนิวเคลียร์ทีและบีลิมโฟไซต์มีความเข้มข้นมากกว่าเซลล์เม็ดเลือดขาวอื่นๆพวกมันเกี่ยวข้องอย่างใกล้ชิดกับภูมิคุ้มกันปรับตัวที่เป็นพิษต่อเซลล์เป็นสื่อกลางเม็ดเลือดขาวสามารถกระตุ้นปฏิกิริยาของเซลล์เพื่อต่อสู้กับการติดเชื้อและปรับตัวเข้ากับผู้บุกรุกนอกจากนี้ไซโตไคน์ที่ได้จาก T-lymphocyte (interferon- γ [IFN- γ] และ interleukin-4 (IL-4) ช่วยเพิ่มโพลาไรเซชันของแมคโครฟาจ Verassar และคณะ ได้รับการพิสูจน์แล้วว่า T lymphocytes ทั่วไปสามารถส่งเสริมการรักษาเนื้อเยื่อทางอ้อมได้ แบบจำลองเมาส์โดยควบคุมความแตกต่างของโมโนไซต์และมาโครฟาจ
Monocyte - เซลล์ซ่อมแซมหลายจุด
ตามอุปกรณ์เตรียม PRP ที่ใช้ โมโนไซต์อาจยื่นออกมาหรือไม่อยู่ในขวดบำบัด PRPน่าเสียดายที่ประสิทธิภาพและความสามารถในการฟื้นฟูไม่ค่อยมีการกล่าวถึงในวรรณคดีดังนั้นจึงให้ความสนใจเพียงเล็กน้อยกับโมโนไซต์ในวิธีการเตรียมหรือสูตรสุดท้ายกลุ่มโมโนไซต์มีความหลากหลาย มีต้นกำเนิดจากเซลล์ต้นกำเนิดในไขกระดูก และขนส่งไปยังเนื้อเยื่อส่วนปลายผ่านทางเซลล์ต้นกำเนิดเม็ดเลือดตามการกระตุ้นสภาพแวดล้อมระดับจุลภาคในระหว่างสภาวะสมดุลและการอักเสบ โมโนไซต์ที่ไหลเวียนจะออกจากกระแสเลือดและถูกคัดเลือกไปยังเนื้อเยื่อที่ได้รับบาดเจ็บหรือเสื่อมโทรมพวกมันสามารถทำหน้าที่เป็นเซลล์เอฟเฟกต์ขนาดมหึมา (M Φ) หรือเซลล์ต้นกำเนิดโมโนไซต์ มาโครฟาจ และเซลล์เดนไดรต์เป็นตัวแทนของระบบทำลายเซลล์โมโนนิวเคลียร์ (MPS) คุณลักษณะทั่วไปของ MPS คือความเป็นพลาสติกของรูปแบบการแสดงออกของยีนและการทับซ้อนกันของการทำงานระหว่างเซลล์ประเภทเหล่านี้ในเนื้อเยื่อเสื่อม แมคโครฟาจประจำถิ่น ปัจจัยการเจริญเติบโตที่ออกฤทธิ์เฉพาะที่ ไซโตไคน์ที่ทำให้เกิดการอักเสบ เซลล์อะพอพโทติกหรือเซลล์เนื้อตาย และผลิตภัณฑ์จากจุลินทรีย์จะเริ่มต้นโมโนไซต์เพื่อแยกความแตกต่างออกเป็นกลุ่มเซลล์ MPSสมมติว่าเมื่อ C-PRP ที่มีโมโนไซต์ที่ให้ผลตอบแทนสูงถูกฉีดเข้าไปในสภาพแวดล้อมจุลภาคเฉพาะที่ของโรค โมโนไซต์มีแนวโน้มที่จะแยกความแตกต่างเป็น M Φ เพื่อทำให้เกิดการเปลี่ยนแปลงเซลล์ที่สำคัญ
จากโมโนไซต์ถึง M Φ ในกระบวนการของการเปลี่ยนแปลง เฉพาะฟีโนไทป์ M Φในช่วงสิบปีที่ผ่านมา มีการพัฒนาแบบจำลองซึ่งรวม M Φ กลไกที่ซับซ้อนของการกระตุ้นถูกอธิบายว่าเป็นโพลาไรเซชันของสถานะที่ตรงกันข้ามสองสถานะ: M Φ ฟีโนไทป์ 1 (M Φ 1, การเปิดใช้งานแบบคลาสสิก) และ M Φ ฟีโนไทป์ 2 (M Φ 2 การเปิดใช้งานทางเลือก)M Φ 1 มีลักษณะเฉพาะคือการหลั่งไซโตไคน์ที่เกิดจากการอักเสบ (IFN- γ) และไนตริกออกไซด์เพื่อสร้างกลไกการฆ่าเชื้อโรคที่มีประสิทธิภาพM Φ ฟีโนไทป์ยังสร้างปัจจัยการเจริญเติบโตของหลอดเลือดบุผนังหลอดเลือด (VEGF) และปัจจัยการเจริญเติบโตของไฟโบรบลาสต์ (FGF)M Φ ฟีโนไทป์ประกอบด้วยเซลล์ต้านการอักเสบที่มีเซลล์ทำลายเซลล์สูงM Φ 2 สร้างส่วนประกอบเมทริกซ์นอกเซลล์ การสร้างเส้นเลือดใหม่และเคมีบำบัด และอินเตอร์ลิวคิน 10 (IL-10)นอกจากการป้องกันเชื้อโรคแล้ว M Φ ยังช่วยลดการอักเสบและส่งเสริมการซ่อมแซมเนื้อเยื่ออีกด้วยเป็นที่น่าสังเกตว่า M Φ 2 ถูกแบ่งออกเป็น M ในหลอดทดลอง Φ 2a、M Φ 2b และ M Φ 2 ขึ้นอยู่กับสิ่งเร้าการแปลชนิดย่อยเหล่านี้ ในสัตว์ทดลอง เป็นเรื่องยากเนื่องจากเนื้อเยื่ออาจมีกลุ่ม M Φ ผสมกันสิ่งที่น่าสนใจขึ้นอยู่กับสัญญาณสิ่งแวดล้อมในท้องถิ่นและระดับ IL-4 สามารถแปลง proflammation M Φ 1 เพื่อส่งเสริมการซ่อมแซม M Φ 2 จากข้อมูลเหล่านี้ มีความสมเหตุสมผลที่จะสรุปได้ว่ามีโมโนไซต์ที่มีความเข้มข้นสูง และการเตรียม M Φ C-PRP อาจมีส่วนช่วยในการซ่อมแซมเนื้อเยื่อได้ดีขึ้น เนื่องจากมีการซ่อมแซมเนื้อเยื่อต้านการอักเสบและมีความสามารถในการถ่ายโอนสัญญาณเซลล์
คำจำกัดความที่สับสนของเศษส่วนเม็ดเลือดขาวใน PRP
การมีอยู่ของเม็ดเลือดขาวในขวดรักษา PRP ขึ้นอยู่กับอุปกรณ์เตรียม PRP และอาจมีความแตกต่างอย่างมีนัยสำคัญมีข้อพิพาทมากมายเกี่ยวกับการมีอยู่ของเม็ดเลือดขาวและการมีส่วนทำให้เกิดผลิตภัณฑ์ sub-PRP ต่างๆ (เช่น PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF และ L-PRF) ในการทบทวนล่าสุด มีการสุ่มตัวอย่าง 6 รายการ การทดลองแบบควบคุม (หลักฐานระดับ 1) และการศึกษาเปรียบเทียบในอนาคตสามรายการ (หลักฐานระดับ 2) เกี่ยวข้องกับผู้ป่วย 1,055 ราย ซึ่งบ่งชี้ว่า LR-PRP และ LP-PRP มีความปลอดภัยใกล้เคียงกันผู้เขียนสรุปว่าอาการไม่พึงประสงค์จาก PRP อาจไม่เกี่ยวข้องโดยตรงกับความเข้มข้นของเม็ดเลือดขาวในการศึกษาอื่น LR-PRP ไม่ได้เปลี่ยนอินเตอร์ลิวคินที่มีการอักเสบ (IL-1) ในข้อเข่า OA β、 IL-6, IL-8 และ IL-17)ผลลัพธ์เหล่านี้สนับสนุนมุมมองที่ว่าบทบาทของเม็ดเลือดขาวในกิจกรรมทางชีวภาพของ PRP ในร่างกาย อาจมาจาก crosstalk ระหว่างเกล็ดเลือดและเม็ดเลือดขาวปฏิกิริยานี้สามารถส่งเสริมการสังเคราะห์ทางชีวภาพของปัจจัยอื่น ๆ (เช่น lipoxygen) ซึ่งสามารถชดเชยหรือส่งเสริมการถดถอยของการอักเสบหลังจากการปล่อยโมเลกุลการอักเสบครั้งแรก (กรดอะราคิโดนิก ลิวโคไตรอีน และพรอสตาแกลนดิน) ไลโปออกซิเจน A4 จะถูกปล่อยออกมาจากเกล็ดเลือดที่ถูกกระตุ้นเพื่อป้องกันการกระตุ้นนิวโทรฟิลในสภาพแวดล้อมนี้เองที่ M Φ ฟีโนไทป์จาก M Φ 1 สลับเป็น M Φ 2。 นอกจากนี้ มีหลักฐานเพิ่มขึ้นว่าเซลล์โมโนนิวเคลียร์ที่หมุนเวียนอยู่สามารถแยกความแตกต่างออกไปเป็นเซลล์ประเภทที่ไม่ใช่ฟาโกไซติกได้หลายประเภทเนื่องจากมีหลายเซลล์
ประเภทของ PRP จะส่งผลต่อวัฒนธรรม MSCเมื่อเปรียบเทียบกับตัวอย่าง PRP หรือ PPP บริสุทธิ์ LR-PRP สามารถกระตุ้นให้เกิดการแพร่กระจายของ MSC ที่ได้มาจากไขกระดูก (BMMSC) ที่สูงขึ้นอย่างมีนัยสำคัญ โดยมีการปลดปล่อยที่รวดเร็วขึ้นและมีฤทธิ์ทางชีวภาพของ PGF ที่ดีขึ้นคุณลักษณะทั้งหมดนี้เอื้อต่อการเพิ่มโมโนไซต์ลงในขวดบำบัด PRP และตระหนักถึงความสามารถในการปรับภูมิคุ้มกันและศักยภาพในการสร้างความแตกต่าง
การควบคุมภูมิคุ้มกันแต่กำเนิดและการปรับตัวของ PRP
หน้าที่ทางสรีรวิทยาที่มีชื่อเสียงที่สุดของเกล็ดเลือดคือการควบคุมการตกเลือดพวกมันสะสมที่บริเวณที่เนื้อเยื่อเสียหายและหลอดเลือดที่เสียหายเหตุการณ์เหล่านี้เกิดจากการแสดงออกของอินทิกรินและซีเลกตินที่กระตุ้นการยึดเกาะและการรวมตัวของเกล็ดเลือดเอ็นโดทีเลียมที่เสียหายจะทำให้กระบวนการนี้รุนแรงขึ้นอีก และคอลลาเจนที่สัมผัสและโปรตีนเมทริกซ์ใต้บุผนังหลอดเลือดอื่นๆ จะส่งเสริมการกระตุ้นเกล็ดเลือดในระดับลึกในกรณีเหล่านี้ บทบาทสำคัญของปฏิสัมพันธ์ระหว่างปัจจัย von Willebrand (vWF) และไกลโคโปรตีน (GP) โดยเฉพาะ GP-Ib ได้รับการพิสูจน์แล้วหลังจากการกระตุ้นเกล็ดเลือด เกล็ดเลือด α-、 ไลโซโซมและทีแกรนูลหนาแน่นจะควบคุมภาวะเอ็กโซไซโตซิสและปล่อยสารออกสู่สภาพแวดล้อมนอกเซลล์
โมเลกุลการยึดเกาะของเกล็ดเลือด
เพื่อให้เข้าใจบทบาทของ PRP ในเนื้อเยื่ออักเสบและเกล็ดเลือดในการตอบสนองของระบบภูมิคุ้มกันได้ดีขึ้น เราควรเข้าใจว่าตัวรับที่พื้นผิวเกล็ดเลือด (อินทิกริน) และโมเลกุลการยึดเกาะของรอยต่อ (JAM) ที่แตกต่างกันและปฏิสัมพันธ์ของเซลล์สามารถเริ่มต้นกระบวนการที่สำคัญในภูมิคุ้มกันโดยธรรมชาติและแบบปรับตัวได้อย่างไร
อินทิกรินเป็นโมเลกุลการยึดเกาะที่ผิวเซลล์ที่พบในเซลล์หลายประเภทและแสดงออกในปริมาณมากบนเกล็ดเลือดอินทิกรินประกอบด้วย a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) และ aIIbb3 (GPIIb/IIIa)โดยปกติแล้ว พวกมันจะอยู่ในสถานะคงที่และมีความสัมพันธ์ต่ำหลังจากเปิดใช้งาน พวกมันจะเปลี่ยนไปสู่สถานะของความสัมพันธ์ในการจับลิแกนด์สูงอินทิกรินมีหน้าที่ต่างกันบนเกล็ดเลือดและมีส่วนร่วมในปฏิกิริยาของเกล็ดเลือดกับเซลล์เม็ดเลือดขาว เซลล์บุผนังหลอดเลือด และเมทริกซ์นอกเซลล์หลายประเภทนอกจากนี้ สารเชิงซ้อน GP-Ib-V-IX ยังแสดงออกบนเยื่อหุ้มเกล็ดเลือดและเป็นตัวรับหลักสำหรับการจับกับ von vWFปฏิสัมพันธ์นี้เป็นสื่อกลางในการติดต่อครั้งแรกระหว่างเกล็ดเลือดและโครงสร้างใต้ชั้นบุผนังหลอดเลือดที่สัมผัสเกล็ดเลือดอินทิกรินและจีพีคอมเพล็กซ์เกี่ยวข้องกับกระบวนการอักเสบต่างๆ และมีบทบาทสำคัญในการก่อตัวของเกล็ดเลือด-เม็ดเลือดขาวที่ซับซ้อนโดยเฉพาะอย่างยิ่ง อินทิกริน aIIbb3 จำเป็นต่อการสร้างสารเชิงซ้อนที่เสถียรโดยการรวมไฟบริโนเจนกับตัวรับมาโครฟาจ 1 แอนติเจน (Mac-1) บนนิวโทรฟิล
เกล็ดเลือด นิวโทรฟิล และเซลล์บุผนังหลอดเลือดแสดงโมเลกุลการยึดเกาะของเซลล์จำเพาะ เรียกว่าซีเลกตินภายใต้สภาวะการอักเสบ เกล็ดเลือดจะแสดง P-selectin และนิวโทรฟิล L-selectinหลังจากการกระตุ้นเกล็ดเลือด P-selectin อาจจับกับลิแกนด์ PSGL-1 ที่มีอยู่ในนิวโทรฟิลและโมโนไซต์นอกจากนี้ การจับ PSGL-1 เริ่มต้นปฏิกิริยาเรียงซ้อนสัญญาณภายในเซลล์ ซึ่งกระตุ้นนิวโทรฟิลผ่านทาง Mac-1 ซึ่งเป็นส่วนประกอบของนิวโทรฟิลและแอนติเจน 1 ที่เกี่ยวข้องกับการทำงานของลิมโฟไซต์ (LFA-1)Mac-1 ที่เปิดใช้งานจะจับกับ GPIb หรือ GPIIb/IIIa บนเกล็ดเลือดผ่านไฟบริโนเจน ดังนั้นจึงทำให้ปฏิสัมพันธ์ระหว่างนิวโทรฟิลและเกล็ดเลือดมีความเสถียรนอกจากนี้ LFA-1 ที่กระตุ้นการทำงานสามารถรวมกับโมเลกุลการยึดเกาะระหว่างเซลล์ของเกล็ดเลือด 2 เพื่อทำให้นิวโทรฟิล-เกล็ดเลือดเชิงซ้อนมีความเสถียรยิ่งขึ้น เพื่อส่งเสริมการยึดเกาะกับเซลล์ในระยะยาว
เกล็ดเลือดและเม็ดเลือดขาวมีบทบาทสำคัญในการตอบสนองทางภูมิคุ้มกันโดยธรรมชาติและแบบปรับตัว
ร่างกายสามารถจดจำสิ่งแปลกปลอมและเนื้อเยื่อที่ได้รับบาดเจ็บในโรคเฉียบพลันหรือเรื้อรัง เพื่อเริ่มต้นปฏิกิริยาการรักษาบาดแผลและวิถีการอักเสบระบบภูมิคุ้มกันโดยธรรมชาติและการปรับตัวช่วยปกป้องโฮสต์จากการติดเชื้อ และเซลล์เม็ดเลือดขาวมีบทบาทสำคัญในการทับซ้อนกันระหว่างทั้งสองระบบโดยเฉพาะอย่างยิ่ง โมโนไซต์ มาโครฟาจ นิวโทรฟิล และเซลล์นักฆ่าตามธรรมชาติมีบทบาทสำคัญในระบบโดยธรรมชาติ ในขณะที่ลิมโฟไซต์และเซลล์ย่อยมีบทบาทคล้ายกันในระบบภูมิคุ้มกันที่ปรับตัวได้
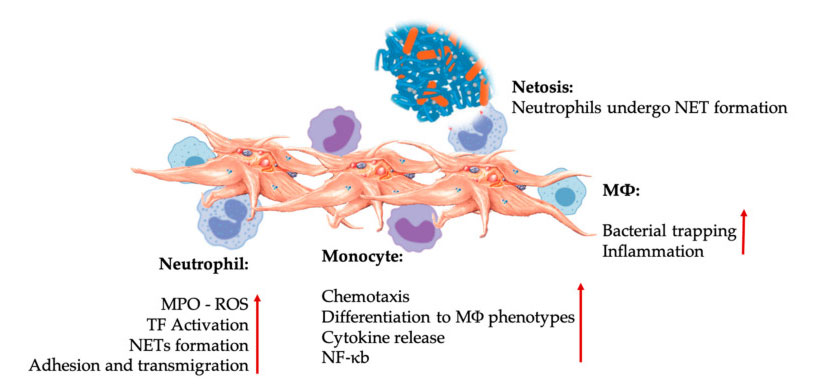
ปฏิกิริยาของเกล็ดเลือดและเม็ดเลือดขาวในปฏิกิริยาระหว่างเซลล์ภูมิคุ้มกันโดยธรรมชาติเกล็ดเลือดมีปฏิกิริยากับนิวโทรฟิลและโมโนไซต์ และสุดท้ายด้วย M Φ โต้ตอบ จะปรับและเพิ่มฟังก์ชันเอฟเฟกต์ของพวกมันปฏิกิริยาระหว่างเกล็ดเลือดและเม็ดเลือดขาวเหล่านี้ทำให้เกิดการอักเสบผ่านกลไกต่าง ๆ รวมถึง NETosisคำย่อ: MPO: myeloperoxidase, ROS: reactive oxygen species, TF: ปัจจัยเนื้อเยื่อ, NET: กับดักนิวโทรฟิลนอกเซลล์, NF- κ B: ปัจจัยนิวเคลียร์ kappa B, M Φ: Macrophages
ระบบภูมิคุ้มกันโดยธรรมชาติ
บทบาทของระบบภูมิคุ้มกันโดยธรรมชาติคือการระบุจุลินทรีย์ที่รุกรานหรือชิ้นส่วนเนื้อเยื่อที่ไม่เฉพาะเจาะจงและกระตุ้นการกวาดล้างของพวกมันเมื่อโครงสร้างโมเลกุลบางชนิดเรียกว่าตัวรับการรับรู้รูปแบบการแสดงออกของพื้นผิว (PRR) รวมกับรูปแบบโมเลกุลที่เกี่ยวข้องกับเชื้อโรคและรูปแบบโมเลกุลที่เกี่ยวข้องกับความเสียหาย ระบบภูมิคุ้มกันโดยกำเนิดจะถูกกระตุ้นPRR มีหลายประเภท รวมถึง Toll-like receptor (TLR) และ RIG-1 like receptor (RLR)ตัวรับเหล่านี้สามารถกระตุ้นปัจจัยการถอดรหัสหลักคัปปาบี (NF- κ B) ได้ นอกจากนี้ยังควบคุมการตอบสนองทางภูมิคุ้มกันโดยธรรมชาติและแบบปรับตัวหลายประการสิ่งที่น่าสนใจคือเกล็ดเลือดยังแสดงโมเลกุลของตัวรับภูมิคุ้มกันที่หลากหลายบนพื้นผิวและไซโตพลาสซึม เช่น P-selectin โปรตีนเมมเบรน CD40 ลิแกนด์ (CD40L) ไซโตไคน์ (เช่น IL-1 β、 TGF- β) และ TLR เฉพาะเกล็ดเลือด ดังนั้นเกล็ดเลือดจึงสามารถโต้ตอบกับเซลล์ภูมิคุ้มกันต่างๆได้
ปฏิกิริยาระหว่างเซลล์เกล็ดเลือดและเซลล์ขาวในภูมิคุ้มกันโดยธรรมชาติ
เมื่อเกล็ดเลือดเข้าสู่หรือบุกรุกการไหลเวียนของเลือดหรือเนื้อเยื่อ เกล็ดเลือดเป็นหนึ่งในเซลล์ที่ตรวจพบการบาดเจ็บของเยื่อบุผนังหลอดเลือดและเชื้อโรคจากจุลินทรีย์ก่อนการรวมตัวของเกล็ดเลือดและส่งเสริมการปล่อยตัวเร่งปฏิกิริยาเกล็ดเลือด ADP, thrombin และ vWF ส่งผลให้เกิดการกระตุ้นเกล็ดเลือดและการแสดงออกของตัวรับเคมีบำบัดเกล็ดเลือด C, CC, CXC และ CX3C จึงทำให้เกิดเกล็ดเลือดในบริเวณที่ติดเชื้อหรือได้รับบาดเจ็บ
ระบบภูมิคุ้มกันโดยธรรมชาติถูกกำหนดไว้ล่วงหน้าทางพันธุกรรมเพื่อตรวจจับผู้บุกรุก เช่น ไวรัส แบคทีเรีย ปรสิตและสารพิษ หรือบาดแผลและบาดแผลของเนื้อเยื่อมันเป็นระบบที่ไม่เฉพาะเจาะจง เพราะเชื้อโรคใดๆ ก็ตามจะถูกระบุได้ว่าเป็นสิ่งแปลกปลอมหรือไม่ใช่ตัวตน และตรวจพบได้อย่างรวดเร็วระบบภูมิคุ้มกันโดยธรรมชาติอาศัยชุดของโปรตีนและฟาโกไซต์ ซึ่งรับรู้ถึงลักษณะเฉพาะของเชื้อโรคที่ได้รับการอนุรักษ์ไว้อย่างดี และกระตุ้นการตอบสนองของระบบภูมิคุ้มกันอย่างรวดเร็วเพื่อช่วยกำจัดผู้บุกรุก แม้ว่าโฮสต์จะไม่เคยสัมผัสกับเชื้อโรคบางชนิดมาก่อนก็ตาม
นิวโทรฟิล โมโนไซต์ และเซลล์เดนไดรต์เป็นเซลล์ภูมิคุ้มกันโดยกำเนิดที่พบมากที่สุดในเลือดการสรรหาบุคลากรเหล่านี้จำเป็นสำหรับการตอบสนองทางภูมิคุ้มกันตั้งแต่เนิ่นๆ อย่างเพียงพอเมื่อใช้ PRP ในเวชศาสตร์ฟื้นฟู ปฏิกิริยาระหว่างเซลล์เกล็ดเลือดกับเซลล์สีขาวจะควบคุมการอักเสบ การสมานแผล และการซ่อมแซมเนื้อเยื่อTLR-4 บนเกล็ดเลือดกระตุ้นปฏิกิริยาระหว่างเกล็ดเลือดกับนิวโทรฟิล ซึ่งควบคุมสิ่งที่เรียกว่าเม็ดเลือดขาวออกซิเดชันโดยควบคุมการปล่อยสายพันธุ์ออกซิเจนปฏิกิริยา (ROS) และไมอีโลเพอรอกซิเดส (MPO) จากนิวโทรฟิลนอกจากนี้ ปฏิสัมพันธ์ระหว่างเกล็ดเลือด-นิวโทรฟิลและการสลายตัวของนิวโทรฟิลทำให้เกิดการก่อตัวของกับดักนิวโทรฟิล-นอกเซลล์ (NETs)NET ประกอบด้วยนิวโทรฟิลนิวเคลียสและเนื้อหาภายในเซลล์ของนิวโทรฟิลอื่นๆ ซึ่งสามารถจับแบคทีเรียและฆ่าพวกมันผ่านทาง NETosisการก่อตัวของ NET เป็นกลไกการฆ่านิวโทรฟิลที่สำคัญ
หลังจากการกระตุ้นเกล็ดเลือด โมโนไซต์สามารถย้ายไปยังเนื้อเยื่อที่เป็นโรคและเนื้อเยื่อเสื่อม ซึ่งพวกมันดำเนินกิจกรรมการยึดเกาะและหลั่งโมเลกุลการอักเสบที่อาจเปลี่ยนคุณสมบัติของเคมีบำบัดและโปรตีโอไลติกนอกจากนี้ เกล็ดเลือดสามารถกระตุ้นการกระตุ้นการทำงานของโมโนไซต์ NF-κ B เพื่อควบคุมการทำงานของเอฟเฟคเตอร์ของโมโนไซต์ ซึ่งเป็นตัวกลางสำคัญของการตอบสนองการอักเสบ การกระตุ้นและการสร้างความแตกต่างของเซลล์ภูมิคุ้มกันเกล็ดเลือดยังส่งเสริมการระเบิดออกซิเดชันภายนอกของโมโนไซต์เพื่อส่งเสริมการทำลายเชื้อโรคที่เกิดจากฟาโกไซติกการปล่อย MPO นั้นเป็นสื่อกลางโดยการทำงานร่วมกันโดยตรงระหว่างเกล็ดเลือด-monocyte CD40L-MAC-1สิ่งที่น่าสนใจคือเมื่อ P-selectin กระตุ้นเกล็ดเลือดภายใต้สภาวะเนื้อเยื่ออักเสบเฉียบพลันและเรื้อรัง เคมีบำบัดที่ได้มาจากเกล็ดเลือด PF4, RANTES, IL-1 β และ CXCL-12 สามารถป้องกันการตายของเซลล์โมโนไซต์ที่เกิดขึ้นเองได้ แต่ส่งเสริมการแยกความแตกต่างออกเป็นแมคโครฟาจ
ระบบภูมิคุ้มกันแบบปรับตัว
หลังจากที่ระบบภูมิคุ้มกันโดยกำเนิดที่ไม่เฉพาะเจาะจงรับรู้ถึงความเสียหายของจุลินทรีย์หรือเนื้อเยื่อแล้ว ระบบภูมิคุ้มกันแบบปรับตัวจำเพาะจะเข้ามาแทนที่ระบบการปรับตัวประกอบด้วยบีลิมโฟไซต์ (บีเซลล์) ที่จับกับแอนติเจนและทีลิมโฟไซต์ทั่วไป (Treg) ที่ประสานการชำระล้างเชื้อโรคทีเซลล์สามารถแบ่งคร่าวๆ ออกเป็นทีเซลล์เฮลเปอร์ (ทีเซลล์) และทีเซลล์ที่เป็นพิษต่อเซลล์ (ทีเซลล์หรือที่รู้จักในชื่อทีเซลล์นักฆ่า)เซลล์ Th แบ่งออกเป็นเซลล์ Th1, Th2 และ Th17 เพิ่มเติม ซึ่งมีหน้าที่สำคัญในการอักเสบเซลล์สามารถหลั่งไซโตไคน์ที่ทำให้เกิดการอักเสบได้ (เช่น IFN- γ、 TNF- β) และอินเตอร์ลิวคินหลายชนิด (เช่น IL-17) พวกมันมีประสิทธิภาพโดยเฉพาะอย่างยิ่งในการป้องกันไวรัสในเซลล์และการติดเชื้อแบคทีเรีย เซลล์ Th กระตุ้นการแพร่กระจายและการแยกเซลล์ที่เกี่ยวข้องกับ การตอบสนองของระบบภูมิคุ้มกัน เซลล์ Tc เป็นเซลล์เอฟเฟกต์ซึ่งสามารถกำจัดจุลินทรีย์และเซลล์ในเซลล์และนอกเซลล์เป้าหมายได้
สิ่งที่น่าสนใจคือ เซลล์ Th2 ผลิต IL-4 และส่งผลต่อ M Φ โพลาไรเซชัน, M Φ การฟื้นฟูตามคำแนะนำ M Φ 2 ฟีโนไทป์ ในขณะที่ IFN- γ M Φ เปลี่ยนเป็นฟีโนไทป์ M Φ 1 ที่มีการอักเสบ ซึ่งขึ้นอยู่กับปริมาณและเวลาของไซโตไคน์หลังจากเปิดใช้งาน IL-4 แล้ว M Φ 2 จะชักนำเซลล์ Treg แยกความแตกต่างออกเป็นเซลล์ Th2 จากนั้นจึงสร้าง IL-4 เพิ่มเติม (ลูปป้อนกลับเชิงบวก)เซลล์ Th แปลง M Φ ฟีโนไทป์มุ่งตรงไปยังฟีโนไทป์ที่สร้างใหม่เพื่อตอบสนองต่อสารทางชีวภาพของต้นกำเนิดของเนื้อเยื่อกลไกนี้มีพื้นฐานมาจากหลักฐานที่ว่าเซลล์ Th มีบทบาทสำคัญในการควบคุมการอักเสบและการซ่อมแซมเนื้อเยื่อ
ปฏิกิริยาระหว่างเซลล์เกล็ดเลือดและเซลล์ขาวในภูมิคุ้มกันแบบปรับตัว
ระบบภูมิคุ้มกันแบบปรับตัวใช้ตัวรับที่จำเพาะต่อแอนติเจนและจดจำเชื้อโรคที่เคยพบมาก่อน และทำลายพวกมันเมื่อเจอกับโฮสต์ในเวลาต่อมาอย่างไรก็ตาม การตอบสนองของภูมิคุ้มกันแบบปรับตัวเหล่านี้พัฒนาอย่างช้าๆโคเนียส และคณะโดยแสดงให้เห็นว่าส่วนประกอบของเกล็ดเลือดมีส่วนช่วยในการรับรู้ความเสี่ยงและการซ่อมแซมเนื้อเยื่อ และปฏิสัมพันธ์ระหว่างเกล็ดเลือดและเม็ดเลือดขาวส่งเสริมการกระตุ้นการตอบสนองของระบบภูมิคุ้มกันแบบปรับตัว
ในระหว่างการตอบสนองทางภูมิคุ้มกันแบบปรับตัว เกล็ดเลือดส่งเสริมการตอบสนองของโมโนไซต์และมาโครฟาจผ่านการสุกของเซลล์ DC และ NK ซึ่งนำไปสู่การตอบสนองของทีเซลล์และบีเซลล์ที่จำเพาะดังนั้นส่วนประกอบของเม็ดเกล็ดเลือดจึงส่งผลโดยตรงต่อภูมิคุ้มกันแบบปรับตัวโดยแสดง CD40L ซึ่งเป็นโมเลกุลที่จำเป็นสำหรับการควบคุมการตอบสนองของระบบภูมิคุ้มกันแบบปรับตัวเกล็ดเลือดผ่าน CD40L ไม่เพียงแต่มีบทบาทในการนำเสนอแอนติเจนเท่านั้น แต่ยังส่งผลต่อปฏิกิริยาของทีเซลล์ด้วยหลิวและคณะพบว่าเกล็ดเลือดควบคุมการตอบสนองของเซลล์ CD4 T ในลักษณะที่ซับซ้อนการควบคุมส่วนต่างของชุดย่อยของเซลล์ CD4 T นี้หมายความว่าเกล็ดเลือดส่งเสริมเซลล์ CD4 T เพื่อตอบสนองต่อสิ่งเร้าการอักเสบ ดังนั้นจึงสร้างการตอบสนองต่อการอักเสบและต้านการอักเสบที่รุนแรง
เกล็ดเลือดยังควบคุมการตอบสนองแบบปรับตัวโดยอาศัยเซลล์ B ต่อเชื้อโรคจุลินทรีย์เป็นที่ทราบกันดีว่า CD40L บน CD4 ทีเซลล์ที่ถูกกระตุ้นจะกระตุ้น CD40 ของบีเซลล์ ซึ่งจัดให้มีสัญญาณที่สองที่จำเป็นสำหรับการกระตุ้นบีลิมโฟไซต์ที่ขึ้นกับทีเซลล์ การแปลงแอลโลไทป์ที่ตามมา และการเปลี่ยนสภาพและการเพิ่มจำนวนของเซลล์บีโดยทั่วไป ผลลัพธ์แสดงให้เห็นอย่างชัดเจนถึงการทำงานต่างๆ ของเกล็ดเลือดในภูมิคุ้มกันแบบปรับตัว ซึ่งบ่งชี้ว่าเกล็ดเลือดเชื่อมต่อปฏิสัมพันธ์ระหว่างทีเซลล์และบีเซลล์ผ่าน CD40-CD40L ซึ่งช่วยเพิ่มการตอบสนองของเซลล์บีที่ขึ้นกับทีเซลล์นอกจากนี้ เกล็ดเลือดยังอุดมไปด้วยตัวรับที่ผิวเซลล์ ซึ่งสามารถส่งเสริมการกระตุ้นเกล็ดเลือดและปล่อยโมเลกุลที่มีฤทธิ์ในการอักเสบและทางชีวภาพจำนวนมากที่เก็บไว้ในอนุภาคเกล็ดเลือดต่างๆ ซึ่งส่งผลต่อการตอบสนองทางภูมิคุ้มกันโดยธรรมชาติและแบบปรับตัว
ขยายบทบาทของเซโรโทนินที่ได้จากเกล็ดเลือดใน PRP
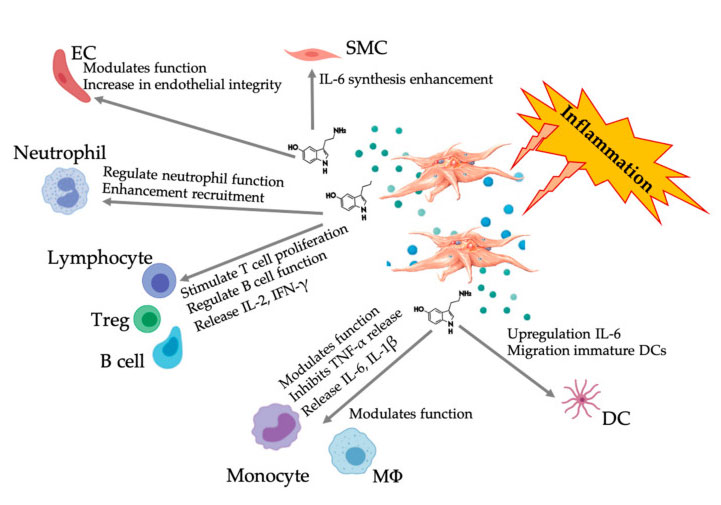
Serotonin (5-hydroxytryptamine, 5-HT) มีบทบาทสำคัญในระบบประสาทส่วนกลาง (CNS) รวมถึงความทนทานต่อความเจ็บปวดประมาณว่า 5-HT ของมนุษย์ส่วนใหญ่ผลิตขึ้นในระบบทางเดินอาหารแล้วผ่านการไหลเวียนของเลือด ซึ่งจะถูกดูดซึมโดยเกล็ดเลือดผ่านทางตัวขนส่งเซโรโทนินที่นำกลับมาใช้ใหม่ และเก็บไว้ในอนุภาคหนาแน่นที่ความเข้มข้นสูง (65 มิลลิโมล/ลิตร)5-HT เป็นสารสื่อประสาทและฮอร์โมนที่รู้จักกันดีซึ่งช่วยควบคุมกระบวนการทางประสาทจิตวิทยาต่างๆ ในระบบประสาทส่วนกลาง (5-HT กลาง)อย่างไรก็ตาม 5-HT ส่วนใหญ่มีอยู่นอกระบบประสาทส่วนกลาง (อุปกรณ์ต่อพ่วง 5-HT) และเกี่ยวข้องกับการควบคุมการทำงานทางชีววิทยาทั้งระบบและเซลล์ของระบบอวัยวะหลายระบบ รวมถึงระบบการทำงานของหัวใจและหลอดเลือด ปอด ระบบทางเดินอาหาร ระบบสืบพันธุ์และเกล็ดเลือด5-HT มีเมแทบอลิซึมที่ขึ้นกับความเข้มข้นในเซลล์หลายประเภท รวมถึงเซลล์ไขมัน เซลล์เยื่อบุผิว และเซลล์เม็ดเลือดขาวอุปกรณ์ต่อพ่วง 5-HT ยังเป็นตัวควบคุมภูมิคุ้มกันที่ทรงพลัง ซึ่งสามารถกระตุ้นหรือยับยั้งการอักเสบ และส่งผลต่อเซลล์ภูมิคุ้มกันต่างๆ ผ่านทางตัวรับ 5-HT (5HTR) ที่จำเพาะของมัน
กลไก Paracrine และ autocrine ของ HT
การออกฤทธิ์ของ 5-HT ถูกสื่อกลางโดยอันตรกิริยาของมันกับ 5HTR ซึ่งเป็นแฟมิลีขั้นสูงที่มีสมาชิกเจ็ดตัว (5-HT 1 – 7) และชนิดย่อยของตัวรับที่แตกต่างกันอย่างน้อย 14 ชนิด ซึ่งรวมถึงส่วนประกอบ 5-HT 7 ที่เพิ่งค้นพบ อุปกรณ์ต่อพ่วงและ ทำหน้าที่ในการจัดการความเจ็บปวดในกระบวนการสลายเกล็ดเลือด เกล็ดเลือดที่ถูกกระตุ้นจะหลั่ง 5-HT ที่ได้มาจากเกล็ดเลือดจำนวนมาก ซึ่งสามารถส่งเสริมการหดตัวของหลอดเลือดและกระตุ้นการกระตุ้นการทำงานของเกล็ดเลือดและเซลล์เม็ดเลือดขาวที่อยู่ติดกันผ่านการแสดงออกของ 5-HTR บนเซลล์บุผนังหลอดเลือด เซลล์กล้ามเนื้อเรียบ และ เซลล์ภูมิคุ้มกันปาคาลา และคณะมีการศึกษาผลไมโทติคของ 5-HT ต่อเซลล์บุผนังหลอดเลือดในหลอดเลือด และพิจารณาศักยภาพในการส่งเสริมการเจริญเติบโตของหลอดเลือดที่เสียหายโดยการกระตุ้นการสร้างเส้นเลือดใหม่วิธีการควบคุมกระบวนการเหล่านี้ยังไม่ชัดเจนนัก แต่อาจเกี่ยวข้องกับเส้นทางสัญญาณสองทางที่แตกต่างกันในวงจรจุลภาคของเนื้อเยื่อ เพื่อควบคุมการทำงานของเซลล์บุผนังหลอดเลือดและเซลล์กล้ามเนื้อเรียบ ไฟโบรบลาสต์ และเซลล์ภูมิคุ้มกันผ่านตัวรับ 5-HT เฉพาะในเซลล์เหล่านี้ .มีการอธิบายฟังก์ชัน autocrine ของเกล็ดเลือด 5-HT หลังจากการกระตุ้นเกล็ดเลือดแล้ว (อ้างอิง)การปล่อย 5-HT ช่วยเพิ่มการกระตุ้นการทำงานของเกล็ดเลือดและการรับเกล็ดเลือดที่หมุนเวียน ซึ่งนำไปสู่การกระตุ้นการทำงานของปฏิกิริยาแบบเรียงซ้อนของสัญญาณและเอฟเฟกต์ต้นน้ำที่สนับสนุนการเกิดปฏิกิริยาของเกล็ดเลือด
ผลภูมิคุ้มกัน 5-HT
หลักฐานมากขึ้นเรื่อยๆ แสดงให้เห็นว่าเซโรโทนินสามารถมีบทบาทใน 5HTR ที่แตกต่างกันในฐานะตัวควบคุมภูมิคุ้มกันจากข้อมูลของ 5HTR ที่แสดงในเม็ดเลือดขาวต่างๆ ที่เกี่ยวข้องกับปฏิกิริยาการอักเสบ 5-HT ที่ได้มาจากเกล็ดเลือดทำหน้าที่เป็นตัวควบคุมภูมิคุ้มกันในระบบภูมิคุ้มกันโดยธรรมชาติและแบบปรับตัว5-HT สามารถกระตุ้นการเพิ่มจำนวน Treg และควบคุมการทำงานของเซลล์ B, เซลล์นักฆ่าตามธรรมชาติ และนิวโทรฟิล โดยการคัดเลือก DC และโมโนไซต์ไปยังบริเวณที่มีการอักเสบการศึกษาล่าสุดแสดงให้เห็นว่า 5-HT ที่ได้มาจากเกล็ดเลือดสามารถควบคุมการทำงานของเซลล์ภูมิคุ้มกันภายใต้สภาวะเฉพาะได้ดังนั้นการใช้ C-PRP ความเข้มข้นของเกล็ดเลือดมากกว่า 1 × 10 6/µ L สามารถช่วยลำเลียงความเข้มข้นของ 5-HT ที่ได้จากเกล็ดเลือดขนาดใหญ่ไปยังเนื้อเยื่อได้อย่างมีนัยสำคัญในสภาพแวดล้อมจุลภาคที่มีส่วนประกอบของการอักเสบ PRP สามารถโต้ตอบกับเซลล์ภูมิคุ้มกันหลายเซลล์ที่มีบทบาทสำคัญในโรคเหล่านี้ ซึ่งอาจส่งผลต่อผลลัพธ์ทางคลินิก
รูปที่แสดงการตอบสนอง 5-HT หลายแง่มุมหลังการกระตุ้นเกล็ดเลือด PRP ที่มีการอักเสบหลังจากการกระตุ้นเกล็ดเลือด เกล็ดเลือดจะปล่อยแกรนูลออกมา รวมทั้ง 5-HT ในแกรนูลหนาแน่น ซึ่งมีผลกระทบที่แตกต่างกันอย่างกว้างขวางต่อเซลล์ภูมิคุ้มกัน เซลล์บุผนังหลอดเลือด และเซลล์กล้ามเนื้อเรียบคำย่อ: SMC: เซลล์กล้ามเนื้อเรียบ, EC: เซลล์บุผนังหลอดเลือด, Treg: T lymphocytes ทั่วไป, M Φ: Macrophages, DC: เซลล์ dendritic, IL: interleukin, IFN- γ: Interferon γ。 ดัดแปลงและดัดแปลงจาก Everts et al.และฮัลล์ และคณะ
ผลยาแก้ปวดของ PRP
เกล็ดเลือดที่ถูกกระตุ้นจะปล่อยสารไกล่เกลี่ยที่ก่อให้เกิดการอักเสบและต้านการอักเสบออกมา ซึ่งไม่เพียงแต่ทำให้เกิดความเจ็บปวด แต่ยังช่วยลดการอักเสบและความเจ็บปวดอีกด้วยเมื่อนำไปใช้แล้ว พลวัตของเกล็ดเลือดโดยทั่วไปของ PRP จะเปลี่ยนสภาพแวดล้อมระดับจุลภาคก่อนการซ่อมแซมและการสร้างเนื้อเยื่อใหม่ผ่านเส้นทางที่ซับซ้อนหลากหลายที่เกี่ยวข้องกับแอแนบอลิซึมและแคแทบอลิซึม การเพิ่มจำนวนเซลล์ การแยกความแตกต่าง และการควบคุมเซลล์ต้นกำเนิดคุณลักษณะของ PRP เหล่านี้นำไปสู่การประยุกต์ PRP ในสภาวะทางพยาธิวิทยาทางคลินิกต่างๆ ซึ่งมักจะเกี่ยวข้องกับอาการปวดเรื้อรัง (เช่น การบาดเจ็บจากการเล่นกีฬา โรคกระดูกและข้อ โรคเกี่ยวกับกระดูกสันหลัง และแผลเรื้อรังที่ซับซ้อน) แม้ว่ากลไกที่แน่นอนจะยังไม่ได้รับการพิจารณาอย่างสมบูรณ์ก็ตาม
ในปี 2551 Evertz และคณะเป็นการทดลองแบบสุ่มที่มีกลุ่มควบคุมครั้งแรกที่รายงานผลยาระงับปวดของการเตรียม PRP ซึ่งเตรียมจากชั้นสีน้ำตาลของอัตราการตกตะกอนของเม็ดเลือดแดงอัตโนมัติ และกระตุ้นด้วย thrombin อัตโนมัติหลังการผ่าตัดไหล่พวกเขาสังเกตเห็นการลดลงอย่างมีนัยสำคัญของคะแนนระดับอะนาล็อกที่มองเห็นได้ การใช้ยาแก้ปวดที่มีสารฝิ่น และการฟื้นฟูสมรรถภาพหลังการผ่าตัดประสบความสำเร็จมากขึ้นเป็นที่น่าสังเกตว่าพวกมันสะท้อนถึงผลยาแก้ปวดของเกล็ดเลือดที่ถูกกระตุ้นและคาดเดากลไกของเกล็ดเลือดที่ปล่อย 5-HTกล่าวโดยสรุป เกล็ดเลือดจะอยู่เฉยๆ ใน PRP ที่เตรียมสดใหม่หลังจากการกระตุ้นเกล็ดเลือดทั้งทางตรงและทางอ้อม (ปัจจัยของเนื้อเยื่อ) เกล็ดเลือดจะเปลี่ยนรูปร่างและผลิตเท็จพอที่จะส่งเสริมการรวมตัวของเกล็ดเลือดจากนั้นพวกมันจะปล่อย α- และอนุภาคหนาแน่นภายในเซลล์ออกมาเนื้อเยื่อที่รักษาด้วยแอคติเวต PRP จะถูกบุกรุกโดย PGF, ไซโตไคน์ และไลโซโซมเกล็ดเลือดอื่นๆโดยเฉพาะอย่างยิ่งเมื่ออนุภาคหนาแน่นปล่อยเนื้อหาออกมา พวกมันจะปล่อย 5-HT จำนวนมากซึ่งควบคุมความเจ็บปวดใน C-PRP ความเข้มข้นของเกล็ดเลือดจะสูงกว่าในเลือดส่วนปลาย 5 ถึง 7 เท่าดังนั้นการปล่อย 5-HT จากเกล็ดเลือดจึงเป็นเรื่องทางดาราศาสตร์สิ่งที่น่าสนใจคือ Sprott และคณะรายงานตั้งข้อสังเกตว่าความเจ็บปวดบรรเทาลงอย่างมีนัยสำคัญหลังจากการฝังเข็มและรมยา ความเข้มข้นของเกล็ดเลือดที่ได้รับ 5-HT ลดลงอย่างมีนัยสำคัญ จากนั้นระดับในพลาสมาของ 5-HT ก็เพิ่มขึ้น
ในบริเวณส่วนปลาย เกล็ดเลือด แมสต์เซลล์ และเซลล์บุผนังหลอดเลือดจะปล่อย 5-HT จากภายนอกในระหว่างการบาดเจ็บของเนื้อเยื่อหรือการบาดเจ็บจากการผ่าตัดสิ่งที่น่าสนใจคือมีการตรวจพบเซลล์ประสาทตัวรับ 5-HT หลายชนิดในบริเวณรอบนอก ซึ่งยืนยันว่า 5-HT สามารถรบกวนการส่งผ่านความรู้สึกเจ็บปวดในพื้นที่รอบนอกได้การศึกษาเหล่านี้แสดงให้เห็นว่า 5-HT สามารถส่งผลต่อการส่งผ่านความรู้สึกเจ็บปวดของเนื้อเยื่อส่วนปลายผ่านตัวรับ 5-HT1, 5-HT2, 5-HT3, 5-HT4 และ 5-HT7
ระบบ 5-HT เป็นระบบอันทรงพลังที่สามารถลดและเพิ่มระดับความเจ็บปวดหลังจากการกระตุ้นที่เป็นอันตรายมีการรายงานการควบคุมสัญญาณ nociceptive ส่วนกลางและอุปกรณ์ต่อพ่วงและการเปลี่ยนแปลงในระบบ 5-HT ในผู้ป่วยที่มีอาการปวดเรื้อรังในช่วงไม่กี่ปีที่ผ่านมา มีการศึกษาจำนวนมากมุ่งเน้นไปที่บทบาทของ 5-HT และตัวรับที่เกี่ยวข้องในการประมวลผลและควบคุมข้อมูลที่เป็นอันตราย ส่งผลให้เกิดยา เช่น Selective serotonin reuptake inhibitors (SSRI)ยานี้ยับยั้งการดูดซึมเซโรโทนินกลับเข้าสู่เซลล์ประสาทพรีไซแนปติกหลังจากปล่อยเซโรโทนินส่งผลต่อระยะเวลาและความรุนแรงของการสื่อสารของเซโรโทนิน และเป็นการรักษาทางเลือกสำหรับอาการปวดเรื้อรังจำเป็นต้องมีการวิจัยทางคลินิกเพิ่มเติมเพื่อให้เข้าใจอย่างชัดเจนถึงกลไกระดับโมเลกุลของการควบคุมความเจ็บปวด 5-HT ที่ได้จาก PRP ในโรคเรื้อรังและความเสื่อม
ข้อมูลอื่นๆ เพื่อแก้ไขผลระงับปวดที่อาจเกิดขึ้นของ PRP สามารถรับได้หลังจากการทดสอบแบบจำลองยาแก้ปวดในสัตว์ข้อสรุปทางสถิติเชิงเปรียบเทียบในแบบจำลองเหล่านี้เป็นเรื่องที่ท้าทายเนื่องจากการศึกษาเหล่านี้มีตัวแปรมากเกินไปอย่างไรก็ตาม การศึกษาทางคลินิกบางชิ้นได้กล่าวถึงผลของการรับความรู้สึกเจ็บปวดและยาแก้ปวดของ PRPการศึกษาหลายชิ้นแสดงให้เห็นว่าผู้ป่วยที่ได้รับการรักษาเอ็นกล้ามเนื้อหรือน้ำตาที่ข้อมือ rotator สามารถบรรเทาอาการปวดได้เพียงเล็กน้อยในทางตรงกันข้าม การศึกษาอื่นๆ อีกหลายชิ้นแสดงให้เห็นว่า PRP สามารถลดหรือขจัดความเจ็บปวดของผู้ป่วยที่มีภาวะเส้นเอ็นเสื่อม OA พังผืดฝ่าเท้าอักเสบ และโรคเท้าและข้อเท้าอื่นๆ ได้ความเข้มข้นของเกล็ดเลือดขั้นสุดท้ายและองค์ประกอบของเซลล์ทางชีวภาพได้รับการระบุว่าเป็นคุณลักษณะสำคัญของ PRP ซึ่งช่วยในการสังเกตผลยาแก้ปวดที่สม่ำเสมอหลังการใช้ PRPตัวแปรอื่นๆ ได้แก่ วิธีการส่ง PRP เทคโนโลยีการประยุกต์ใช้ โปรโตคอลการเปิดใช้งานเกล็ดเลือด ระดับการออกฤทธิ์ทางชีวภาพของ PGF และไซโตไคน์ที่ปล่อยออกมา ประเภทของเนื้อเยื่อของการใช้ PRP และประเภทของการบาดเจ็บ
เป็นที่น่าสังเกตว่า Kuffler แก้ไขศักยภาพของ PRP ในการบรรเทาความเจ็บปวดในผู้ป่วยที่มีอาการปวดเส้นประสาทเรื้อรังเล็กน้อยถึงรุนแรง รองจากเส้นประสาทที่ไม่สามารถสร้างใหม่ได้การศึกษานี้มีวัตถุประสงค์เพื่อศึกษาว่าอาการปวดจากโรคระบบประสาทสามารถลดลงหรือลดลงได้หรือไม่เนื่องจาก PRP ส่งเสริมการฟื้นฟูแอกซอนและการฟื้นฟูเส้นประสาทเป้าหมายน่าประหลาดใจที่ในผู้ป่วยที่ได้รับการรักษา อาการปวดจากโรคระบบประสาทยังคงหายไปหรือบรรเทาลงอย่างน้อยหกปีหลังการผ่าตัดนอกจากนี้ผู้ป่วยทุกรายเริ่มบรรเทาอาการปวดได้ภายใน 3 สัปดาห์หลังการฉีด PRP
เมื่อเร็ว ๆ นี้ พบว่าผลของ PRP ระงับปวดที่คล้ายกันในด้านบาดแผลหลังผ่าตัดและการดูแลผิวสิ่งที่น่าสนใจคือผู้เขียนรายงานลักษณะทางสรีรวิทยาของอาการปวดบาดแผลที่เกี่ยวข้องกับการบาดเจ็บของหลอดเลือดและภาวะขาดออกซิเจนของเนื้อเยื่อผิวหนังพวกเขายังได้หารือถึงความสำคัญของการสร้างเส้นเลือดใหม่ในการเพิ่มประสิทธิภาพการให้ออกซิเจนและการส่งสารอาหารการศึกษาของพวกเขาแสดงให้เห็นว่าเมื่อเทียบกับกลุ่มควบคุม ผู้ป่วยที่ได้รับการรักษาด้วย PRP มีความเจ็บปวดน้อยกว่าและเพิ่มการสร้างเส้นเลือดใหม่อย่างมีนัยสำคัญในที่สุด Johal และเพื่อนร่วมงานของเขาได้ทำการทบทวนอย่างเป็นระบบและการวิเคราะห์เมตาดาต้า และสรุปว่า PRP สามารถลดความเจ็บปวดได้หลังจากใช้ PRP ในการบ่งชี้ทางกระดูกและข้อ โดยเฉพาะอย่างยิ่งในผู้ป่วยที่ได้รับยา Epicondylitis ภายนอกและการรักษาข้อเข่าเสื่อมน่าเสียดายที่การศึกษานี้ไม่ได้ระบุผลกระทบของเซลล์เม็ดเลือดขาว ความเข้มข้นของเกล็ดเลือด หรือการใช้ตัวกระตุ้นเกล็ดเลือดจากภายนอก เนื่องจากตัวแปรเหล่านี้จะส่งผลต่อประสิทธิภาพโดยรวมของ PRPความเข้มข้นของเกล็ดเลือด PRP ที่เหมาะสมที่สุดเพื่อการบรรเทาอาการปวดสูงสุดยังไม่ชัดเจนในหนูทดลองของ Tendinosis ความเข้มข้นของเกล็ดเลือดอยู่ที่ 1.0 × 10 6 / μ ที่ L ความเจ็บปวดจะบรรเทาลงได้อย่างสมบูรณ์ ในขณะที่การบรรเทาอาการปวดที่เกิดจาก PRP ที่มีความเข้มข้นของเกล็ดเลือดครึ่งหนึ่งจะลดลงอย่างมีนัยสำคัญดังนั้นเราจึงสนับสนุนการศึกษาทางคลินิกเพิ่มเติมเพื่อตรวจสอบผลยาแก้ปวดของการเตรียม PRP ต่างๆ
ผลของ PRP และการสร้างเส้นเลือดใหม่
การเตรียม C-PRP ในเวชศาสตร์ฟื้นฟูที่แม่นยำช่วยให้สามารถส่งชีวโมเลกุลที่ปล่อยออกมาจากเกล็ดเลือดที่มีความเข้มข้นสูงซึ่งทำงานที่บริเวณเนื้อเยื่อเป้าหมายดังนั้นจึงเกิดปฏิกิริยาแบบเรียงซ้อนที่หลากหลาย ซึ่งมีส่วนช่วยในการควบคุมภูมิคุ้มกัน ณ จุดเกิดเหตุ กระบวนการอักเสบ และการสร้างเส้นเลือดใหม่ เพื่อส่งเสริมการรักษาและการซ่อมแซมเนื้อเยื่อ
การสร้างเส้นเลือดใหม่เป็นกระบวนการไดนามิกหลายขั้นตอนที่เกี่ยวข้องกับการงอกและหลอดเลือดขนาดเล็กของเนื้อเยื่อจากหลอดเลือดที่มีอยู่ก่อนการสร้างเส้นเลือดใหม่มีความก้าวหน้าเนื่องจากกลไกทางชีววิทยาที่หลากหลาย รวมถึงการย้ายเซลล์บุผนังหลอดเลือด การแพร่กระจาย การแยกความแตกต่าง และการแบ่งตัวกระบวนการเซลล์เหล่านี้เป็นข้อกำหนดเบื้องต้นสำหรับการสร้างหลอดเลือดใหม่พวกมันจำเป็นสำหรับการเจริญเติบโตของหลอดเลือดที่มีอยู่เดิมเพื่อฟื้นฟูการไหลเวียนของเลือดและสนับสนุนกิจกรรมการเผาผลาญในระดับสูงของการซ่อมแซมเนื้อเยื่อและการสร้างเนื้อเยื่อใหม่หลอดเลือดใหม่เหล่านี้ช่วยให้สามารถส่งออกซิเจนและสารอาหารได้ และกำจัดผลพลอยได้จากเนื้อเยื่อที่ได้รับการบำบัด
กิจกรรมการสร้างเส้นเลือดใหม่ถูกควบคุมโดยการกระตุ้นปัจจัยสร้างเส้นเลือดใหม่ VEGF และปัจจัยต่อต้านการสร้างเส้นเลือดใหม่ (เช่น angiostatin และ thrombospondin-1 [TSP-1])ในสภาพแวดล้อมจุลภาคที่เป็นโรคและเสื่อมโทรม (รวมถึงความตึงเครียดของออกซิเจนต่ำ ค่า pH ต่ำ และระดับกรดแลคติคสูง) ปัจจัยที่สร้างเส้นเลือดใหม่ในท้องถิ่นจะช่วยฟื้นฟูการทำงานของการสร้างเส้นเลือดใหม่
ตัวกลางที่ละลายเกล็ดเลือดได้หลายชนิด เช่น FGF พื้นฐานและ TGF-β และ VEGF สามารถกระตุ้นเซลล์บุผนังหลอดเลือดให้สร้างหลอดเลือดใหม่ได้Landsdown และ Fortier รายงานผลลัพธ์ต่างๆ ที่เกี่ยวข้องกับองค์ประกอบของ PRP รวมถึงแหล่งที่มาในเกล็ดเลือดของสารควบคุมการสร้างเส้นเลือดใหม่จำนวนมากนอกจากนี้ พวกเขาสรุปว่าการเพิ่มขึ้นของการสร้างเส้นเลือดใหม่มีส่วนช่วยในการรักษาโรค MSK ในพื้นที่ที่มีการสร้างหลอดเลือดไม่ดี เช่น การฉีกขาดของวงเดือน การบาดเจ็บที่เส้นเอ็น และบริเวณอื่น ๆ ที่มีการสร้างหลอดเลือดไม่ดี
ส่งเสริมและต่อต้านคุณสมบัติเกล็ดเลือด angiogenic
ในช่วงไม่กี่ทศวรรษที่ผ่านมา การศึกษาที่ตีพิมพ์ได้พิสูจน์ให้เห็นว่าเกล็ดเลือดมีบทบาทสำคัญในการห้ามเลือดขั้นต้น การสร้างลิ่มเลือด ปัจจัยการเจริญเติบโตและการปล่อยไซโตไคน์ และการควบคุมการสร้างเส้นเลือดใหม่ ซึ่งเป็นส่วนหนึ่งของกระบวนการซ่อมแซมเนื้อเยื่อในทางตรงข้าม PRP α- เม็ดประกอบด้วยคลังแสงของปัจจัยการเจริญเติบโตที่สร้างเส้นเลือดใหม่ โปรตีนต่อต้านการสร้างเส้นเลือดใหม่ และไซโตไคน์ (เช่น PF4, สารยับยั้งแอคติเวเตอร์พลาสมิโนเจน-1 และ TSP-1) และกำหนดเป้าหมายการปลดปล่อยปัจจัยเฉพาะที่มีบทบาท .บทบาทในการสร้างเส้นเลือดใหม่ดังนั้นบทบาทของ PRP ในการควบคุมการควบคุมการสร้างเส้นเลือดใหม่อาจถูกกำหนดโดยการกระตุ้นการทำงานของตัวรับผิวเซลล์จำเพาะ TGF- β เริ่มต้นปฏิกิริยาโปรแองจิเจนิกและแอนติเจเจนิกความสามารถของเกล็ดเลือดในการดำเนินการวิถีการสร้างเส้นเลือดใหม่ได้รับการยืนยันในการสร้างเส้นเลือดใหม่ทางพยาธิวิทยาและการสร้างเส้นเลือดใหม่ด้วยเนื้องอก
ปัจจัยการเจริญเติบโตของหลอดเลือดที่ได้มาจากเกล็ดเลือดและปัจจัยการเจริญเติบโตที่ต่อต้านการสร้างเส้นเลือดใหม่ ซึ่งได้มาจาก α- และโมเลกุลที่มีความหนาแน่นและยึดติดสิ่งสำคัญที่สุดคือ เป็นที่ยอมรับกันโดยทั่วไปว่าผลกระทบโดยรวมของเกล็ดเลือดต่อการสร้างเส้นเลือดใหม่นั้นเป็นการส่งเสริมการสร้างเส้นเลือดใหม่และเป็นการกระตุ้นคาดว่าการบำบัดด้วย PRP จะควบคุมการกระตุ้นการสร้างเส้นเลือดใหม่ ซึ่งจะส่งผลต่อผลการรักษาโรคต่างๆ เช่น การสมานแผลและการซ่อมแซมเนื้อเยื่อการบริหารให้ PRP โดยเฉพาะอย่างยิ่งการบริหารให้ PGF ที่มีความเข้มข้นสูงและไซโตไคน์ของเกล็ดเลือดอื่นๆ สามารถกระตุ้นให้เกิดการสร้างเส้นเลือดใหม่ การสร้างเส้นเลือดใหม่และการสร้างเส้นเลือดใหม่ เนื่องจากปัจจัย 1a ที่ได้มาจากเซลล์สโตรมัลจับกับตัวรับ CXCR4 บนเซลล์ต้นกำเนิดบุผนังหลอดเลือดบิล และคณะแนะนำว่า PRP จะเพิ่มภาวะหลอดเลือดใหม่ขาดเลือด ซึ่งอาจเกิดจากการกระตุ้นการสร้างเส้นเลือดใหม่ การสร้างเส้นเลือดใหม่และการสร้างเส้นเลือดใหม่ในแบบจำลองภายนอกร่างกาย การแพร่กระจายของเซลล์บุผนังหลอดเลือดและการก่อตัวของเส้นเลือดฝอยถูกกระตุ้นโดย PDG ที่แตกต่างกันจำนวนมาก ซึ่ง VEGF เป็นตัวกระตุ้นการสร้างเส้นเลือดใหม่ปัจจัยที่สำคัญและจำเป็นอีกประการหนึ่งสำหรับการฟื้นฟูวิถีการสร้างเส้นเลือดใหม่คือการทำงานร่วมกันระหว่าง PGF หลายตัวริชาร์ดสัน และคณะได้รับการพิสูจน์แล้วว่ากิจกรรมการทำงานร่วมกันของปัจจัยการเจริญเติบโตของเกล็ดเลือดที่ได้มาจากปัจจัยการเจริญเติบโตของหลอดเลือด (PDGF-BB) และ VEGF นำไปสู่การก่อตัวอย่างรวดเร็วของเครือข่ายหลอดเลือดที่เติบโตเต็มที่เมื่อเปรียบเทียบกับกิจกรรมของปัจจัยการเจริญเติบโตส่วนบุคคลผลรวมของปัจจัยเหล่านี้ได้รับการยืนยันเมื่อเร็ว ๆ นี้ในการศึกษาเกี่ยวกับการเพิ่มการไหลเวียนของหลักประกันในสมองในหนูที่มีภาวะเลือดในเลือดต่ำในระยะยาว
สิ่งสำคัญที่สุดคือ การศึกษาในหลอดทดลองวัดผลการเพิ่มจำนวนของเซลล์บุผนังหลอดเลือดดำสะดือของมนุษย์และความเข้มข้นของเกล็ดเลือดต่างๆ ในการเลือกอุปกรณ์เตรียม PRP และกลยุทธ์การให้ยาเกล็ดเลือด และผลลัพธ์แสดงให้เห็นว่าขนาดเกล็ดเลือดที่เหมาะสมคือ 1.5 × 10 6 เกล็ดเลือด/μ 50. เพื่อส่งเสริมการสร้างเส้นเลือดใหม่ความเข้มข้นของเกล็ดเลือดสูงเกินไปอาจยับยั้งกระบวนการสร้างเส้นเลือดใหม่ ดังนั้นผลที่ได้จึงไม่ดี
การแก่ของเซลล์ การแก่ชรา และ PRP
การชราภาพของเซลล์สามารถเกิดขึ้นได้จากสิ่งเร้าต่างๆนี่เป็นกระบวนการที่เซลล์หยุดการแบ่งตัวและเกิดการเปลี่ยนแปลงทางฟีโนไทป์ที่เป็นเอกลักษณ์ เพื่อป้องกันการเจริญเติบโตของเซลล์ที่เสียหายอย่างไม่จำกัด ซึ่งมีบทบาทสำคัญในการป้องกันมะเร็งในกระบวนการชราทางสรีรวิทยา การแก่ชราของการจำลองเซลล์จะส่งเสริมการแก่ชราของเซลล์ด้วย และความสามารถในการงอกใหม่ของ MSC จะลดลง
ผลของความชราและความชราของเซลล์
ในร่างกาย เซลล์หลายประเภทจะแก่ตัวและสะสมในเนื้อเยื่อต่างๆ ในช่วงอายุ ซึ่งในจำนวนนี้มีเซลล์แก่ชราจำนวนมากการสะสมของเซลล์ที่แก่ชราดูเหมือนจะเพิ่มขึ้นตามอายุที่เพิ่มขึ้น ความเสียหายของระบบภูมิคุ้มกัน ความเสียหายของเนื้อเยื่อ หรือปัจจัยที่เกี่ยวข้องกับความเครียดกลไกของการแก่ชราของเซลล์ได้รับการระบุว่าเป็นปัจจัยที่ทำให้เกิดโรคที่เกี่ยวข้องกับอายุ เช่น โรคข้อเข่าเสื่อม โรคกระดูกพรุน และการเสื่อมของหมอนรองกระดูกสันหลังสิ่งเร้าที่หลากหลายจะทำให้เซลล์แก่ชรามากขึ้นในการตอบสนองฟีโนไทป์ของการหลั่งที่เกี่ยวข้องกับการชราภาพ (SASP) จะหลั่งเซลล์โปรตีนและไซโตไคน์ที่มีความเข้มข้นสูงฟีโนไทป์พิเศษนี้เกี่ยวข้องกับเซลล์ที่แก่ชรา ซึ่งพวกมันหลั่งไซโตไคน์ที่มีการอักเสบในระดับสูง (เช่น IL-1, IL-6, IL-8), ปัจจัยการเจริญเติบโต (เช่น TGF- β、 HGF, VEGF, PDGF) MMP และคาเทซินเมื่อเปรียบเทียบกับคนหนุ่มสาว SAPS ได้รับการพิสูจน์แล้วว่าเพิ่มขึ้นตามอายุ เนื่องจากกระบวนการคงตัวถูกทำลาย ส่งผลให้เกิดการแก่ชราของเซลล์และความสามารถในการงอกใหม่ลดลงโดยเฉพาะโรคข้อและโรคกล้ามเนื้อโครงร่างในเรื่องนี้ การแก่ชราของภูมิคุ้มกันถือเป็นการเปลี่ยนแปลงที่สำคัญในสเปกตรัมการหลั่งของเซลล์ภูมิคุ้มกัน ซึ่งบ่งชี้ว่าความเข้มข้นของ TNF-a, IL-6 และ/หรือ Il-1b เพิ่มขึ้น นำไปสู่การอักเสบเรื้อรังระดับต่ำเป็นที่น่าสังเกตว่าความผิดปกติของเซลล์ต้นกำเนิดยังเกี่ยวข้องกับกลไกอิสระที่ไม่ใช่เซลล์ เช่น เซลล์ที่แก่ชรา โดยเฉพาะอย่างยิ่งการผลิตปัจจัยที่ทำให้เกิดการอักเสบและต่อต้านการสร้างใหม่ผ่าน SASP
ในทางตรงกันข้าม SASP ยังสามารถกระตุ้นความเป็นพลาสติกของเซลล์และการเขียนโปรแกรมใหม่ของเซลล์ที่อยู่ติดกันนอกจากนี้ SASP ยังสามารถจัดระเบียบการสื่อสารกับผู้ไกล่เกลี่ยภูมิคุ้มกันต่างๆ และกระตุ้นการทำงานของเซลล์ภูมิคุ้มกันเพื่อส่งเสริมการขจัดเซลล์ที่แก่ชราการทำความเข้าใจบทบาทและหน้าที่ของเซลล์ที่แก่ชราจะส่งผลต่อการรักษาและการเปลี่ยนแปลงเนื้อเยื่อของกล้ามเนื้อ MSK และบาดแผลเรื้อรัง
เป็นที่น่าสังเกตว่า Ritcka และคณะมีการศึกษาอย่างกว้างขวาง และค้นพบบทบาทหลักและเป็นประโยชน์ของ SASP ในการส่งเสริมความเป็นพลาสติกของเซลล์และการสร้างเนื้อเยื่อใหม่ และแนวคิดของการส่งมอบการรักษาชั่วคราวของเซลล์ที่แก่ชราได้ถูกนำเสนอพวกเขากล่าวอย่างระมัดระวังว่าการแก่ชรานั้นเป็นกระบวนการที่เป็นประโยชน์และฟื้นฟูเป็นหลัก
ความชราของเซลล์และศักยภาพของ PRP
เมื่อจำนวนสเต็มเซลล์ลดลง การแก่ชราจะส่งผลต่อประสิทธิภาพของสเต็มเซลล์ในทำนองเดียวกัน ในมนุษย์ คุณลักษณะของเซลล์ต้นกำเนิด (เช่น ความแห้ง การแพร่กระจาย และความแตกต่าง) ก็จะลดลงตามอายุเช่นกันWang และ Nirmala รายงานว่าการแก่ชราจะลดลักษณะของเซลล์ต้นกำเนิดเซลล์เส้นเอ็นและจำนวนตัวรับปัจจัยการเจริญเติบโตการศึกษาในสัตว์ทดลองพบว่าความเข้มข้นของ PDGF ในม้าอายุน้อยอยู่ในระดับสูงพวกเขาสรุปว่าการเพิ่มจำนวนตัวรับ GF และจำนวน GF ในคนหนุ่มสาวอาจมีการตอบสนองของเซลล์ต่อการรักษาด้วย PRP ได้ดีกว่าผู้สูงอายุในคนหนุ่มสาวการค้นพบนี้เผยให้เห็นว่าเหตุใดการรักษาด้วย PRP จึงอาจมีประสิทธิผลน้อยลงหรือไม่ได้ผลในผู้ป่วยสูงอายุที่มีสเต็มเซลล์น้อยลงและ "มีคุณภาพไม่ดี"ได้รับการพิสูจน์แล้วว่ากระบวนการชราของกระดูกอ่อนที่แก่ชรานั้นกลับกัน และระยะเวลาพักของเซลล์กระดูกอ่อนจะเพิ่มขึ้นหลังการฉีด PRPเจียและคณะใช้ในการศึกษาไฟโบรบลาสต์ของผิวหนังในหนูทดลองด้วยการถ่ายภาพในหลอดทดลอง โดยมีและไม่มีการรักษาด้วย PRP เพื่อชี้แจงกลไกของการตอบโต้ของ PGF ในแบบจำลองนี้กลุ่ม PRP แสดงผลโดยตรงต่อเมทริกซ์นอกเซลล์ เพิ่มคอลลาเจนชนิดที่ 1 และลดการสังเคราะห์ของ metalloproteinases ซึ่งบ่งชี้ว่า PRP สามารถต่อต้านการแก่ชราของเซลล์ได้ และยังรวมถึงโรค MSK ที่เสื่อมถอยด้วย
ในการศึกษาอื่น มีการใช้ PRP เพื่อรวบรวมเซลล์ต้นกำเนิดจากไขกระดูกจากหนูที่มีอายุมากมีการพิจารณาว่า PRP สามารถฟื้นฟูการทำงานของสเต็มเซลล์ได้หลากหลายตั้งแต่อายุ เช่น การเพิ่มจำนวนเซลล์และการก่อตัวของโคโลนี และสร้างเครื่องหมายที่เกี่ยวข้องกับการแก่ชราของเซลล์ขึ้นใหม่
เมื่อเร็วๆ นี้ Oberlohr และเพื่อนร่วมงานของเขาได้ศึกษาบทบาทของการแก่ชราของเซลล์ในการฟื้นฟูกล้ามเนื้อที่อ่อนแอ และประเมิน PRP และพลาสมาที่มีเกล็ดเลือดต่ำ (PPP) เป็นทางเลือกในการรักษาทางชีวภาพสำหรับการซ่อมแซมกล้ามเนื้อโครงร่างพวกเขาจินตนาการว่าการรักษาด้วย PRP หรือ PPP สำหรับการซ่อมแซมกล้ามเนื้อโครงร่างจะขึ้นอยู่กับปัจจัยทางชีววิทยาที่ปรับแต่งสำหรับเครื่องหมายเซลล์เฉพาะของ SASP และปัจจัยอื่นๆ ที่นำไปสู่การพัฒนาของพังผืด
มีเหตุผลที่จะเชื่อได้ว่าก่อนการใช้ PRP การแก่ชราของเซลล์เป้าหมายสามารถปรับปรุงลักษณะการงอกใหม่ของประสิทธิภาพการรักษาทางชีวภาพได้โดยการลดปัจจัย SASP ในท้องถิ่นมีการเสนอว่าอีกทางเลือกหนึ่งในการปรับปรุงผลลัพธ์ของการรักษา PRP และ PPP สำหรับการฟื้นฟูกล้ามเนื้อโครงร่างคือการเลือกกำจัดเซลล์ที่แก่ชราด้วยสารกำจัดของเก่าไม่ต้องสงสัยเลยว่าผลการวิจัยล่าสุดเกี่ยวกับผลของ PRP ต่อการแก่ของเซลล์และการแก่ชรานั้นน่าสนใจ แต่ก็ยังอยู่ในช่วงเริ่มต้นจึงไม่สมควรที่จะเสนอแนะใดๆ ในเวลานี้
(เนื้อหาของบทความนี้ได้รับการตีพิมพ์ซ้ำ และเราไม่ได้ให้การรับประกันทั้งโดยชัดแจ้งหรือโดยนัยเกี่ยวกับความถูกต้อง ความน่าเชื่อถือ หรือความสมบูรณ์ของเนื้อหาที่มีอยู่ในบทความนี้ และไม่รับผิดชอบต่อความคิดเห็นของบทความนี้ โปรดเข้าใจ)
เวลาโพสต์: Mar-01-2023